T細胞免疫療法仍然是一種有吸引力的癌癥免疫治療方法。T細胞免疫療法主要采用嵌合抗原受體(CAR)和T細胞受體(TCR)工程化的T細胞。CAR-T細胞療法已成為治療血液系統惡性腫瘤的一項重要突破。TCR-T細胞可以識別在細胞表面和細胞內表達的抗原。雖然TCR-T細胞尚未被批準用于臨床,但已經進行了許多臨床試驗,特別是對實體瘤。在這里,總結了目前TCR-T細胞進展及其在實體瘤免疫治療中的潛在優勢。
前言
細胞免疫療法在癌癥治療方面顯示出巨大潛力。該方法使用基因工程技術修飾T細胞,使其具有識別和殺傷腫瘤細胞的能力。目前,T細胞免疫治療有兩種:嵌合抗原受體T(CAR-T)細胞和T細胞受體(TCR)工程T細胞。在這些方法中,CAR-T細胞療法在臨床試驗中顯示出令人振奮的結果,并且已有幾種產品被批準用于治療血液系統惡性腫瘤。它在實體瘤中的效果仍然不理想。目前,TCR-T細胞治療已被證明在實體瘤治療方面具有巨大潛力。這里主要總結了利用腫瘤抗原特異性TCR-T細胞進行抗實體瘤免疫治療的研究現狀。
TCR-T細胞構建
TCR是T細胞表面的一種分子,它特異性識別和介導免疫反應,由兩個二硫鍵連接的高度可變的異質肽鏈組成。TCR包括4個肽鏈,α、β、γ和δ。α和β肽鏈形成αβ TCR,而γ和δ肽鏈形成γδ TCR。αβ TCR通過與腫瘤細胞或抗原呈遞細胞(APC)上的主要組織相容性復合物(MHC)結合來激活TCR信號通路,然后激活一系列細胞內蛋白,包括CD3ζ、70-kD zeta相關蛋白(ZAP70)和活化T細胞2(NFAT2)的核因子,從而介導T細胞免疫功能。TCR-T細胞是通過基因工程將特異性識別腫瘤抗原的TCR基因序列轉移到T細胞中來構建的,從而使T細胞具有特異性殺傷腫瘤細胞的能力。TCR-T細胞不僅可以識別腫瘤細胞表面的特異性抗原,還可以識別細胞內抗原,這使得TCR-T細胞能夠識別更廣譜的靶抗原。
為了構建TCR修飾的T細胞,第一步是分離并獲得特異性識別腫瘤特異性抗原(TSA)或腫瘤相關抗原(TAA)表位的TCR。TCR可以從患者腫瘤組織中的腫瘤浸潤T細胞或MHC I/II限制性TSA或TAA肽誘導的健康供體T細胞中分離出來。一旦獲得具有最高親和力的T細胞克隆,就可借助分子克隆將TCR α β鏈克隆到靶T細胞中,以獲得特異性識別腫瘤抗原的能力(圖1)。獲得腫瘤抗原特異性TCR的方法也在不斷改進。研究人員發現,特定的TCR Vβ克隆可以通過聚合酶鏈反應(PCR)和基因掃描識別白血病患者的白血病相關抗原。還發現,與慢性髓系白血病(CML)相關的TCR Vβ克隆通過用MHC限制性抗原肽和TCR Vβ基因序列刺激健康供體中的T細胞來特異性識別Wilm的腫瘤1(WT1)抗原肽。最近,還發現了與肺癌患者預后密切相關的TCR Vβ克隆。最近通過單細胞測序分析了B細胞急性淋巴白血病(B-ALL)患者T細胞的TCR Vα和Vβ鏈基因,發現患者的T細胞具有多克隆亞型,其中大多數是效應子亞型。這些結果表明,通過單細胞測序可以獲得特異性配對的腫瘤抗原TCR Vα和Vβ鏈序列,可為后續構建特異性高親和力TCR-T細胞提供更準確的信息。2019年Kisielow等人提出了一種篩選特異性T細胞表位的新技術【見參考文獻】。通過構建pMHC-TCR(MCR)工程報告細胞,能夠篩選特異性識別病毒和腫瘤抗原的MHC II T細胞表位。還證明,通過該平臺篩選的腫瘤新抗原相關淋巴細胞可以保護小鼠免受腫瘤細胞的侵害。這些發現表明,這些技術的組合應用可能能夠識別和幫助構建個體患者的腫瘤抗原特異性的高親和力TCR-T細胞。
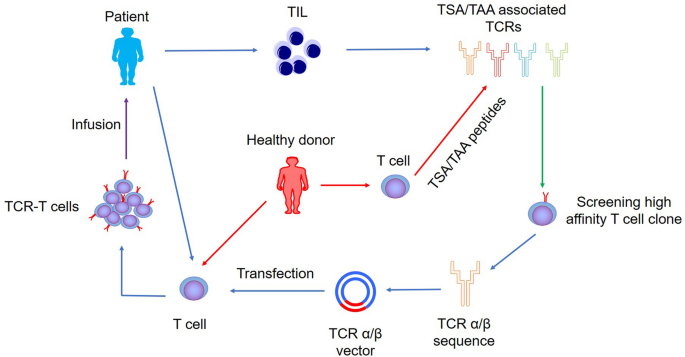
●圖1 臨床應用TCR-T細胞構建制備示意圖。
01 TCR-T細胞開發過程
自20世紀90年代以來,許多研究報道在黑色素瘤患者的腫瘤浸潤淋巴細胞(TILs)和外周血中發現了特異性TCR Vα/Vβ T細胞克隆。這些克隆T細胞具有特異性抗黑色素瘤細胞毒性,在體外擴增的特異性單鏈TCR Vβ T細胞具有特異性殺傷作用。已經證明逆轉錄病毒產生的TCRαβ基因轉導系統可以重建小鼠外周T細胞的抗原特異性免疫。還證實,通過基因工程構建的特異性TCR α/β T細胞可以在體外有效殺傷CML細胞。這些結果表明,單鏈和雙鏈TCR-T細胞都可以有效地識別和殺傷靶細胞。
小鼠仍然是研究腫瘤特異性TCR-T細胞療法的主要模式生物,使用的主要T細胞模型是αβ CTL。在臨床環境中,在設計癌癥患者免疫療法時,動態分析克隆增殖性TCR Vβ亞族T細胞的持久性與疾病狀態之間的關系,可以提供關于特定細胞免疫功能的更詳細信息。一項研究表明,在大細胞肺癌患者中存在持續的TCR Vα5 /Vβ7 CTL克隆,該克隆在手術后3年仍可檢測到。這些數據表明,該T細胞克隆的持久性可能與該患者持續緩解的維持有關。黑色素瘤臨床試驗也表明,靶向Melan-A特異性CD8 CTL細胞可以有效緩解患者病情。由于γδ T細胞不依賴于MHC,它們在腫瘤特異性免疫治療中也起著重要作用。供體外周血誘導的γδ T細胞可有效殺傷腫瘤細胞,例如Vγ9Vδ2 T細胞可溶解肝癌和直腸癌細胞,但對正常組織無細胞毒性作用。此外,一些研究表明,一類表面表達自然殺傷分子1.1(NK1.1)的T細胞可能在缺乏HLA-I分子表達的腫瘤細胞中起細胞毒性作用。例如,粘蛋白1(MUC1)抗原在前列腺癌細胞中表達,但幾乎所有轉移性癌細胞都缺乏HLA-I分子;因此,轉移性癌細胞不能被T細胞特異性識別。然而,該抗原可能通過刺激NK細胞在抗腫瘤細胞中起有效作用。因此γδ T細胞和NK T細胞也被用于構建TCR-T和TCR-NK細胞。
02 臨床前研究
TCR-T細胞的體外和動物實驗開始非常早,研究人員于1986年在小鼠T細胞中成功轉導MHC限制性TCRα和TCRβ基因。1999年成功地將黑色素瘤特異性TCR Vα和Vβ鏈轉移到人外周血原代T細胞中,并證實該方法構建的TCR-T細胞可以在體外有效殺傷腫瘤細胞。隨著鑒定方法和實驗技術的不斷進步,對體外和動物腫瘤模型中TCR-T細胞的研究越來越多。使用逆轉錄病毒載體在外周血T細胞中構建了編碼B16黑色素瘤抗原gp100的前黑素小體蛋白1(PMEL-1)TCR,并且以這種方式構建的TCR可以有效地減緩B16荷瘤小鼠腫瘤細胞的發展。研究證明,靶向酪氨酸酶(一種參與黑色素合成的酶)的TCR-T細胞也可以有效地殺傷體內B16/A2K(b)小鼠黑色素瘤細胞。這一結果進一步證實了TCR-T細胞識別的抗原不僅位于細胞表面,而且位于細胞內。研究人員通過γ逆轉錄病毒(MSGV1)在小鼠CD8 T細胞中構建MHC-I限制性黑素細胞分化抗原100(PEML-1)TCR,并在小鼠CD4 T細胞中構建MHC-II限制性酪氨酸酶相關蛋白1(TRP-1)TCR。研究證實,MSGV1-PEML-1 TCR-CD8 T細胞和MSGV1-TRP-1 TCR-CD4 T細胞均可有效殺傷B16黑色素瘤小鼠的腫瘤細胞。該結果進一步闡明了CD8和CD4 T細胞在抗腫瘤過程中的功能和相互作用。在小鼠模型中將卵清蛋白(OVA)特異性OT-1 TCRαβ基因轉導為γδ T細胞,證實以這種方式構建的TCR-T細胞可以有效地殺傷腫瘤細胞并避免衍生的TCRαβ鏈之間的內部二聚化。這些數據表明,使用不同類型的T細胞構建TCR-T細胞可以維持抗腫瘤作用并避免不良反應。這些結果也拓寬了構建TCR-T細胞的細胞選擇范圍。最近,有研究人員構建了HLA-A*02:01限制性新抗原文庫,將其轉移到HLA匹配的APC中,以刺激患者外周血中的T細胞。然后,該小組篩選并構建了靶向KIAA1429D1258E突變的新抗原特異性TCR,這些TCR-T細胞在小鼠體內顯示出殺傷人頭頸部鱗狀細胞癌的效率。該結果為在難以獲得腫瘤組織的條件下篩選突變新抗原特異性TCRs提供了新的策略。此外,這一發現表明,針對突變抗原的TCR-T細胞的構建和對攜帶突變抗原的精確個體化免疫療法的特異性殺傷可能是臨床試驗的一種策略。
03 臨床研究
TCR-T細胞在癌癥患者中的臨床試驗相對較早。1999年構建了由T細胞識別的黑色素瘤抗原1(MART-1),靶向人原代T細胞的TCR-T細胞,并成功地將其輸注到黑色素瘤患者體內。2006年報道,研究者向15名黑色素瘤患者輸注了特異性識別MART-1的TCR-T細胞,并成功在2名患者中實現了緩解。這些結果進一步證實了特異性識別腫瘤抗原的TCR-T細胞治療腫瘤的潛力。表1總結了TCR-T細胞療法在實體瘤中的臨床試驗信息。
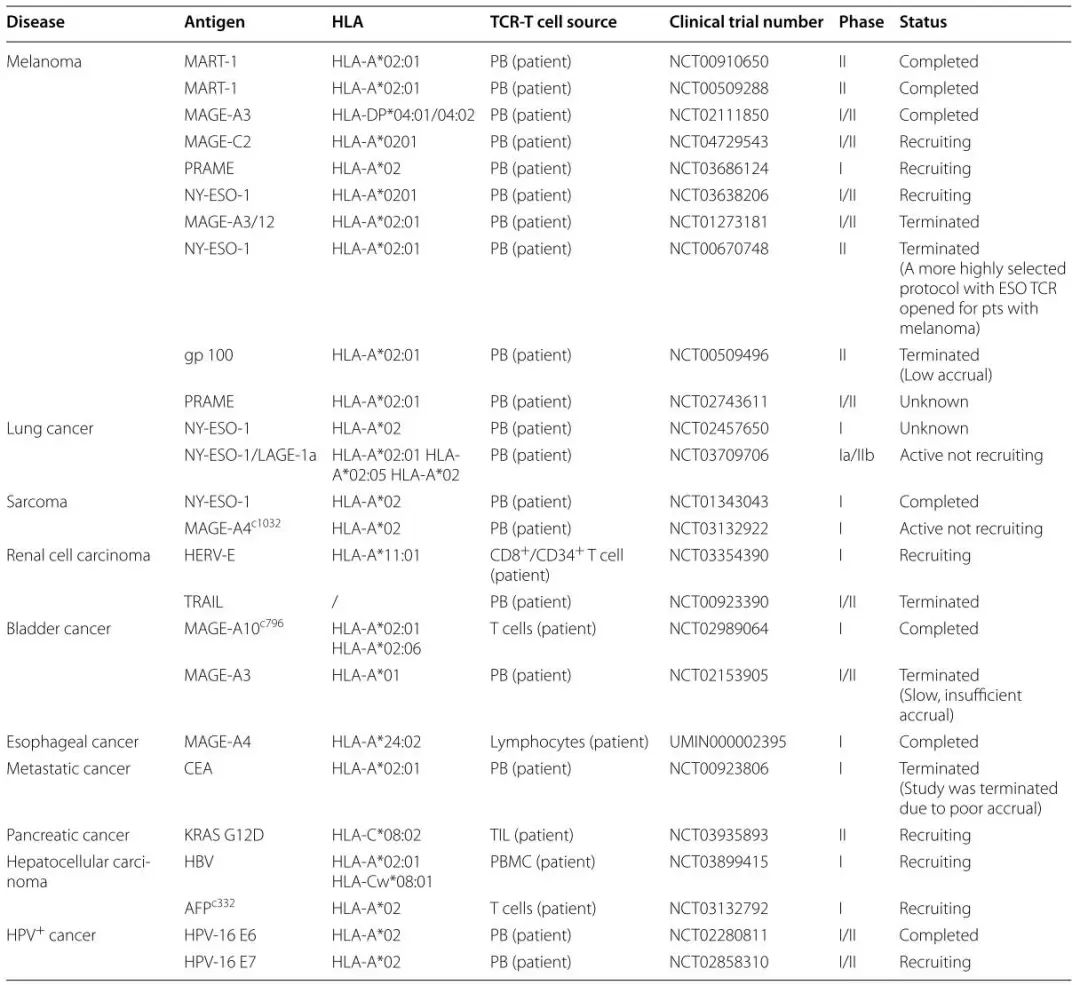
●表1 實體瘤患者TCR-T細胞療法的主要臨床試驗。
黑色素瘤
TCR-T細胞治療實體瘤的臨床試驗首先在黑色素瘤患者中進行。多種黑色素瘤相關抗原也被證實具有特異性TCR治療潛力,其中最具吸引力的兩種腫瘤相關抗原是MART-1和NY-ESO-1。
靶向MART-1 TCR-T細胞聯合樹突狀細胞疫苗的臨床試驗結果表明,13名患者中有9名(69%)在治療后腫瘤消退。在這些患者中,3例接受非冷凍保存細胞治療的患者MART-1 TCR-T細胞的持久性較長,但2例患者出現嚴重的不良急性呼吸窘迫事件,需要干預。這一結果表明,新鮮細胞可能是構建具有更持久抗腫瘤反應的TCR-T細胞的理想細胞模型,同時確定如何減少其副作用需要進一步研究。另一項靶向MART-1 TCR-T細胞輸注的臨床試驗表明,20例接受MART-1 TCR-T細胞治療的患者中有20%有反應,而接受靶向gp100 TCR-T細胞的16例患者中有19%有反應。同樣,臨床試驗也顯示,20例黑色素瘤患者中有11例對靶向NY-ESO-1 TCR-T細胞治療有反應。還有兩項靶向黑色素瘤抗原基因A3(MAGE-A3)TCR-T細胞治療黑色素瘤的臨床試驗。其中一個(NCT01273181)由于不同程度的神經元損傷而被終止,另一個(NCT02111850)已經完成,但結果尚未公布。目前,有許多TCR-T細胞用于治療黑色素瘤患者的臨床試驗(NCT02743611、NCT03686124、NCT04729543 和 NCT03638206)。
非小細胞肺癌
隨著靶向藥物和免疫療法的發展,非小細胞肺癌(NSCLC)的治療得到了顯著改善,并使許多患者受益。NSCLC的TCR-T細胞治療已經取得了一些進展,靶向NY-ESO-1 TCR-T細胞已顯示出潛力。一項臨床試驗的結果表明,接受靶向NY-ESO-1 TCR-T細胞輸注的4例NSCLC患者中,2例有反應,無重毒性。另一項正在進行的臨床試驗(NCT03709706)正在評估TCR-T細胞在接受NY-ESO-1 / LAGE-1a TCR-T細胞單獨治療或與抗PD-1抗體pembrolizumab聯合治療的晚期/復發性NSCLC患者中的安全性和耐受性。這項研究的結果有助于更好地了解TCR-T細胞治療在NSCLC中的作用。在臨床試驗CTONG 1104中發現,在具有EGFR突變的NSCLC患者中,TCR Vβ5-6 Jβ2-1、TCR Vβ20-1 Jβ2-1和TCR Vβ24-1 Jβ2-1與吉非替尼組的良好總生存期(OS)相關,而TCR Vβ29-1 Jβ2-7與常規化療組的良好OS相關。這些結果表明,基于這些特異性TCRs并結合現有靶向治療的TCR-T細胞可能使更多的NSCLC患者受益。此外,識別、鑒定和構建識別腫瘤突變衍生的新抗原的TCRs也是一個有吸引力的研究方向。
肉瘤
由于NY-ESO-1和MAGE-A4在大約80%的滑膜肉瘤細胞中表達,因此肉瘤的TCR-T細胞的臨床試驗主要針對這兩種抗原。共有42名患者參加了NY-ESO-1 TCR-T細胞療法的I/ II期臨床試驗。結果顯示:1例患者達到完全緩解(CR)、14例患者部分緩解(PR)、24例病情穩定(SD)、3例PD。結果表明,輸注的TCR-T細胞的擴增反應與NY-ESO-1在患者腫瘤細胞上的表達有關。另一項涉及NY-ESO-1 TCR-T細胞治療45例晚期肉瘤患者的I期臨床試驗報告,1例患者CR,14例患者PR,25例患者SD。正在進行的I期臨床試驗NCT03132922中,MAGE-A4 C1032靶向16例晚期滑膜肉瘤患者的初步結果顯示,44%患者PR,而50%患者SD。這些臨床試驗的初步結果顯然表明,TCR-T細胞免疫療法可能是治療肉瘤的潛在策略。然而,需要更多的研究來證明TCR-T細胞的有效性和安全性以促進其臨床應用。
腎細胞癌
已經進行了兩項針對腎細胞癌(RCC)的TCR-T細胞治療臨床試驗。一項NCT00923390的I / II期臨床試驗是針對TNF相關凋亡誘導配體(TRAIL)的TCR-T細胞,該試驗招募了5名轉移性RCC患者。遺憾的是,這項試驗在開始10年后終止,結果沒有公布。目前正在進行另一項轉移性RCC的I期臨床試驗,以評估人內源性逆轉錄病毒-E(HERV-E)TCR-T細胞的療效和安全性。據報道,靶向滋養層糖蛋白(5T4)的TCR-T細胞在體外具有腫瘤殺傷作用,超過90%的RCC細胞表達5T4抗原。這一發現表明,5T4可能是RCC中TCR-T細胞治療的潛在靶抗原。同樣,需要更多的體外和體內研究來評估5T4特異性TCR-T細胞在治療RCC中的療效和安全性。
膀胱癌
已經對膀胱癌的TCR-T細胞療法進行了一些臨床試驗,但沒有顯著的結果。例如,MAGE-A3 HLA-A*01限制性TCR-T細胞治療轉移性膀胱癌的臨床試驗由于設計不充分而不得不終止。在另一項評估MAGE-A10 TCR-T細胞對3例膀胱癌患者療效的I期臨床試驗中,盡管TCR-T細胞耐受性良好,但抗腫瘤作用較弱。總體而言,膀胱癌的TCR-T細胞療法需要進一步研究。
食道癌
使用逆轉錄病毒載體構建靶向MAGE-A4抗原的TCR-T細胞。一項納入10例食管癌患者的臨床試驗顯示,MAGE-A4 TCR-T細胞在5例患者中持續存在超過5個月,3例腫瘤負荷最低的患者的OS值超過27個月。在這項臨床試驗中,還觀察到盡管輸注的TCR-T細胞在患者中持續存在,但沒有臨床反應。該結果可能與在輸注 TCR-T 細胞之前IL-2給藥的淋巴細胞清除缺失有關。這些結果表明,在輸注TCR-T細胞之前進行淋巴細胞清除預處理可以提高TCR-T細胞治療的療效。
結直腸癌
癌胚抗原(CEA)是一種在轉移性結直腸癌細胞中高度表達的抗原。2011年研究人員構建了靶向CEA(691-699)的TCR-T細胞,被證明在小鼠模型中有效識別和靶向HLA-A*0201限制性人CEA結腸癌細胞。盡管該TCR-T細胞在3名CEA高表達患者的臨床試驗中顯示出抗腫瘤能力,但2名患者在治療后5-6個月出現PD,而另一名患者則沒有反應。此外,所有3例患者均在接受靶向CEA TCR-T細胞輸注后1周出現重度結腸炎。這種類型的結腸炎可能是由靶向CEA TCR-T細胞引起的自身免疫性結腸炎。這些結果表明,篩選在結直腸癌細胞上特異性表達的抗原將是開發利用TCR-T細胞進行結直腸癌免疫治療的重要關鍵步驟。
胰腺癌
最近,Leidner等人報告說【見參考文獻】,1例轉移性胰腺癌患者接受了TCR-T細胞治療,并且內臟轉移灶消退, 6個月后持續有效(NCT03935893)。這些TCR-T細胞來自基因工程改造的自體T細胞,克隆表達兩個靶向突變KRAS G12D的同種異體HLA-C*08:02限制性TCRs。眾所周知,KRAS突變在腫瘤中很常見,G12D是KRAS的單氨基酸突變,是最常見的突變,見于胰管腺癌等多種癌癥。該結果為胰腺癌提供了有希望的新型細胞免疫治療方法,胰腺癌是所有常見癌癥中最致命的,缺乏有效的特異性靶向治療。此外,KRAS G12D-TCR-T細胞可進一步嘗試用于治療攜帶KRAS G12D突變的癌癥患者,如NSCLC和結直腸癌。
肝癌
肝細胞癌(HCC)中TCR-T細胞的幾項臨床試驗正在進行中。這些試驗主要選擇NY-ESO-1和MAGE-A1作為TCR-T細胞的靶抗原。由于TCR-T細胞不僅可以識別細胞表面的抗原,還可以識別細胞內抗原,因此甲胎蛋白(AFP)和乙肝病毒(HBV)在臨床試驗中也成為TCR-T細胞的有吸引力的靶抗原。
首例接受靶向HBV TCR-T細胞治療的患者接受了肝移植,乙型肝炎病毒表面抗原(HBsAg)陰性,但肝外HCC轉移為HBsAg陽性。血清HBsAg水平在接受HBV TCR-T細胞輸注后30天內顯著下降。不幸的是,沒有臨床反應,患者在8個月后死亡。
在另一項針對HBV陽性HCC患者的I期臨床試驗中,8例患者接受了靶向HBV TCR-T細胞(LioCyx-M)回輸治療。在該試驗中,1名患者PR持續了30個月,而2名患者患有SD,并且所有3名患者在接受TCR-T細胞輸注后血清趨化因子水平均升高。這種TCR-T細胞療法目前正在進行II期臨床試驗,以進一步評估其效果。這些結果表明,靶向HBV TCR-T細胞治療可能對HCC的治療有效,但需要更多的試驗結果來支持它。
在第一項針對HCC患者的ADP-A2AFP TCR-T細胞臨床試驗中,9例接受TCR-T細胞治療,1例患者獲得6個月的CR,6例患者SD,2例患者PD。該試驗的結果表明,靶向AFP TCR-T細胞可能是治療HCC的另一種有效策略。
人乳頭瘤病毒(HPV)陽性癌癥
靶向HPV E6和E7抗原治療HPV癌的TCR-T細胞的研究一直是許多研究的重點。目前,已經對靶向HPV E6和E7抗原的TCR-T細胞療法進行了臨床試驗。這些臨床試驗招募了頭頸部腫瘤、宮頸癌、肛門癌、陰道癌和外陰癌的患者。
研究人員【見參考文獻】針對HPV16 E6 TCR-T細胞進行了I / II期臨床試驗。在該試驗的12名患者中,2名肛門癌患者分別持續了6個月和3個月的PR。1例陰道癌患者、1例頭頸部腫瘤患者和2例宮頸子宮患者均有SD。這些結果表明,靶向HPV16 E6 TCR-T細胞具有抗HPV腫瘤細胞的作用。在這項臨床試驗中,研究人員還發現了與宮頸癌患者T細胞反應相關的IFNGR1突變。HPV16 E6 TCR-T細胞所需的限制性MHC,在治療后的PD患者中也發現了的HLA-A*0201缺失。這一發現表明,TCR-T細胞在HPV腫瘤的治療中可能會錯過或失敗,進一步了解導致這些現象的因素和機制將有助于提高HPV16 E6 TCR-T細胞治療HPV腫瘤的療效。
在另一項靶向HPV E7抗原的研究中,成功構建了具有HLA-A*0201限制性E7(11-19)的高親和力TCR-T細胞,并被證明可有效在體外殺傷腫瘤細胞。在該TCR-T細胞輸注的臨床試驗(NCT02858310)中,共招募了12名患者,6名患者PR,4名患者SD。在這些患者中,多發性轉移的患者在接受TCR-T細胞治療后維持PR 9個月,并且體內大多數轉移性病變被完全消除。目前,NCT02858310的II期分支臨床試驗已經開放,以進一步評估HPV E7 TCR-T細胞在最大耐受劑量下的療效和安全性,說明靶向HPV E7 TCR-T細胞治療在治療HPV陽性癌患者中具有其作用,希望這種療法將使更多的患者受益。
TCR-T細胞治療的障礙
盡管TCR-T細胞療法是治療癌癥的一種理想細胞免疫療法,但它仍然面臨限制其應用的障礙。
01 TCR錯配
TCR錯配TCR錯配是TCR-T細胞治療的障礙。基因工程T細胞引入的外源性TCR αβ基因序列與T細胞的內源性TCR αβ基因序列之間可能存在一些錯配。由這種錯配引起的基因工程T細胞可以識別并攻擊患者自身的組織。這種現象是在基因工程T細胞的小鼠模型中發現的,這些T細胞由錯配的TCR產生,導致移植物抗宿主病(GVHD)。有兩種常用方法可以減少TCR錯配的發生:一種是使用siRNA 、鋅指核酸酶、轉錄激活子樣效應核酸酶(TALEN)和簇狀排列的短回文重復序列相關蛋白9(CRISPR/Cas9)技術敲除內源性TCRs;另一種是選擇γδ T細胞或NK細胞作為構建TCR-T細胞的來源細胞,可以在一定程度上避免αβTCR的錯配。
02 非特異性細胞毒性
TCR-T細胞的非特異性細胞毒性主要是指所謂的抗原特異性TCR-T細胞也攻擊表達與抗原相似的抗原或表位的健康組織。有研究小組在使用靶向MART-1和MAGE-A3的TCR-T細胞治療黑色素瘤時發現了致命的心臟毒性,這可能與心臟組織中MART-1和MAGE-A3的高表達有關。研究人員還發現,3例轉移性結直腸癌患者接受靶向CEA(691-699)的TCR-T細胞治療后出現重度結腸炎。因此,選擇腫瘤特異性抗原作為構建TCR-T細胞的靶標的原則是避免選擇在健康組織中表達的抗原,特別是在重要器官中。靶向腫瘤基因突變產生的新抗原可能是降低TCR-T細胞非特異性細胞毒性的有效方法。在臨床試驗CTONG 1104(第一代EGFR-TKI佐劑吉非替尼提高了切除EGFR突變NSCLC伴N1/N2轉移的無病生存期(DFS))中,發現NSCLC患者中顯著的TCR重排(Vβ5-6-Jβ2-1,Vβ20-1-Jβ2-1,Vβ24-1-Jβ2-1和Vβ29-1-Jβ2-7)與良好的總生存期(OS)相關,并且可能對腫瘤基因突變具有特異性反應。因此,隨著免疫庫測序、單細胞測序和MCR工程報告細胞技術的綜合應用,獲取和構建靶向新抗原的TCR-T細胞可能是癌癥免疫治療的一種潛在策略。
03 細胞因子風暴
細胞因子風暴是T細胞免疫治療最常見的不良反應。在細胞因子風暴患者中檢測到顯著升高的細胞因子,包括IL-6、、IFN-γ、IL-10、IL-2R、單核細胞趨化蛋白-1(MCP-1)和巨噬細胞炎癥蛋白-1β(MIP-1β)。這些患者主要的不良反應有高燒、肌痛、低血壓和呼吸困難。細胞因子風暴的嚴重程度與腫瘤負荷有關,而在細胞免疫治療之前減少腫瘤負荷可以在一定程度上降低細胞因子風暴的風險。因此,預防和控制細胞因子風暴的風險可以提高TCR-T細胞療法等細胞免疫療法的安全性和有效性。
04 腫瘤微環境
腫瘤微環境(TME)是影響T細胞功能的重要因素。趨化因子表達降低,如C-X-C基序趨化因子配體9(CXCL9)、CXCL10、CXCL11和細胞間粘附分子-1(ICAM-1)粘附分子與T細胞浸潤相關的粘附分子,通過影響T細胞遷移和粘附,抑制T細胞浸潤到腫瘤部位。其次,TME中的低氧可促進腫瘤細胞、腫瘤相關巨噬細胞(TAM)和髓系抑制細胞(MDSC)中程序性細胞死亡配體1(PD-L1)的高表達。PD-L1與T細胞上的PD-1結合,然后調節T細胞耗竭【10.1084/jem.20131916】。低氧還可導致高鉀水平和酸性環境,從而影響T細胞分泌細胞因子的能力和活性【10.1038/nature19364】。此外,TME中的其他免疫抑制細胞,如調節性T細胞(Treg)、MDSCs和TAMs,可以通過分泌免疫抑制因子(如IL-10)和轉化生長因子-β(TGF-β)來抑制CD8 T細胞識別和殺傷腫瘤細胞的能力【10.1007/s40259-019-00368-z】。因此,聯合靶向TME治療可能是提高TCR-T細胞免疫療法療效的潛在策略。
總結
綜上,TCR-T細胞療法已被證明在實體瘤的體外研究和臨床試驗中都具有吸引力。這種基因工程T細胞的優點是它們可以識別和靶向缺乏特異性表面腫瘤標志物的實體瘤中的細胞內腫瘤新抗原。隨著腫瘤免疫學的發展和免疫組庫測序、單細胞轉錄測序等新技術的應用,TCR-T細胞在實體瘤免疫治療中可能具有更大的潛力。
參考文獻:
Chen C, et al. Predictive value of TCR Vbeta-Jbeta profile for adjuvant gefitinib in EGFR mutant NSCLC from ADJUVANT-CTONG 1104 trial. JCI Insight. 2022;7(1):e152631.
Zhang Y, et al. Identification of TCR Vbeta11-2-Dbeta1-Jbeta1-1 T cell clone specific for WT1 peptides using high-throughput TCRbeta gene sequencing. Biomark Res. 2019;7:12.
Wang X, et al. Single-Cell RNA-Seq of T Cells in B-ALL patients reveals an exhausted subset with remarkable heterogeneity. Adv Sci (Weinh). 2021;8(19):e2101447.
Kisielow J, et al. Deciphering CD4 T cell specificity using novel MHC-TCR chimeric receptors. Nat Immunol. 2019;20(5):652–62.
Wei T, et al. Generation of neoantigen-specific T cells for adoptive cell transfer for treating head and neck squamous cell carcinoma. Oncoimmunology. 2021;10(1):1929726.
Leidner R, et al. Neoantigen T-cell receptor gene therapy in pancreatic cancer. N Engl J Med. 2022;386(22):2112–9.
Doran SL, et al. T-cell receptor gene therapy for human papillomavirus-associated epithelial cancers: a first-in-human, phase I/II study. J Clin Oncol. 2019;37(30):2759–68.
Zhang, Y., et al. (2022). TCR engineered T cells for solid tumor immunotherapy. Experimental Hematology & Oncology, 11(1), 38.
